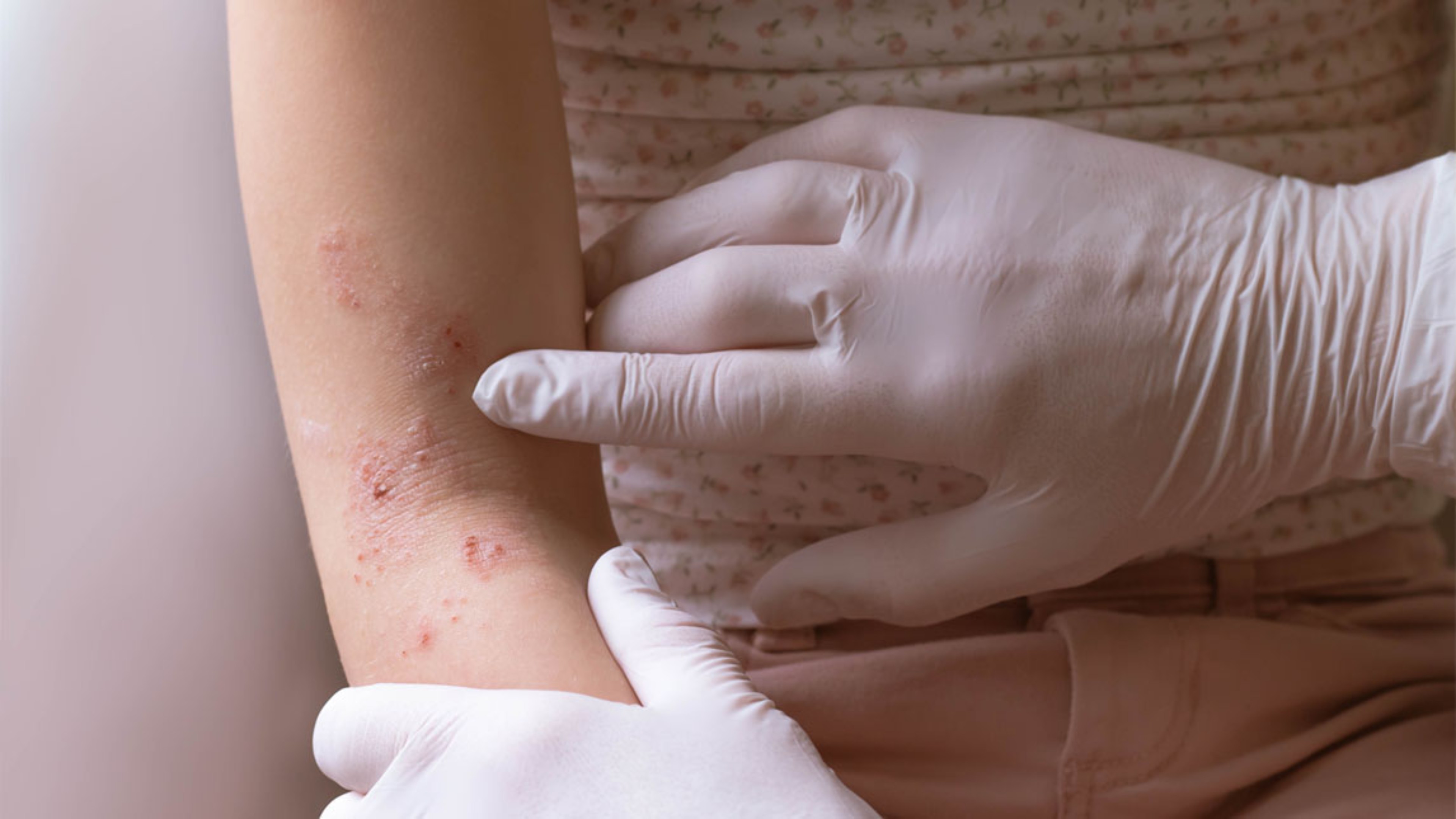
Poser des mots sur la maladie : diagnostiquer la dermatite atopique
Le diagnostic de la dermatite atopique repose essentiellement sur l’analyse des signes cliniques, dont les localisations varient selon l’âge du patient1,2. Il ne faut pour autant pas oublier de prendre en considération la sévérité de la maladie qui se traduit par un lourd fardeau au quotidien1.