- Article
- Source : Campus Sanofi
- 8 mars 2023
La maladie de Fabry chez les femmes

Qu’est-ce que la maladie de Fabry?
Une maladie génétique rare, transmise par le chromosome X
La maladie de Fabry est une maladie héréditaire rare due à des variants pathogènes du gène GLA (situé sur le chromosome X), responsables d’un déficit enzymatique en alpha-galactosidase A. Elle résulte en une accumulation de glycosphingolipides au niveau cellulaire (Gb3) et plasmatique (lyso-Gb3). Cette accumulation débutant dès le plus jeune âge engendre des atteintes multisystémiques et irréversibles. Ces dernières sont responsables d’une morbi-mortalité élevée à l’âge adulte en l’absence de traitement.1
Pour en savoir plus, découvrez l’article : Qu’est-ce-vous la maladie de Fabry ?
La transmission de la maladie de Fabry est liée au chromosome X :
Une femme potentiellement atteinte présente 50% de risque de transmettre son X muté, quel que soit le sexe de son enfant.
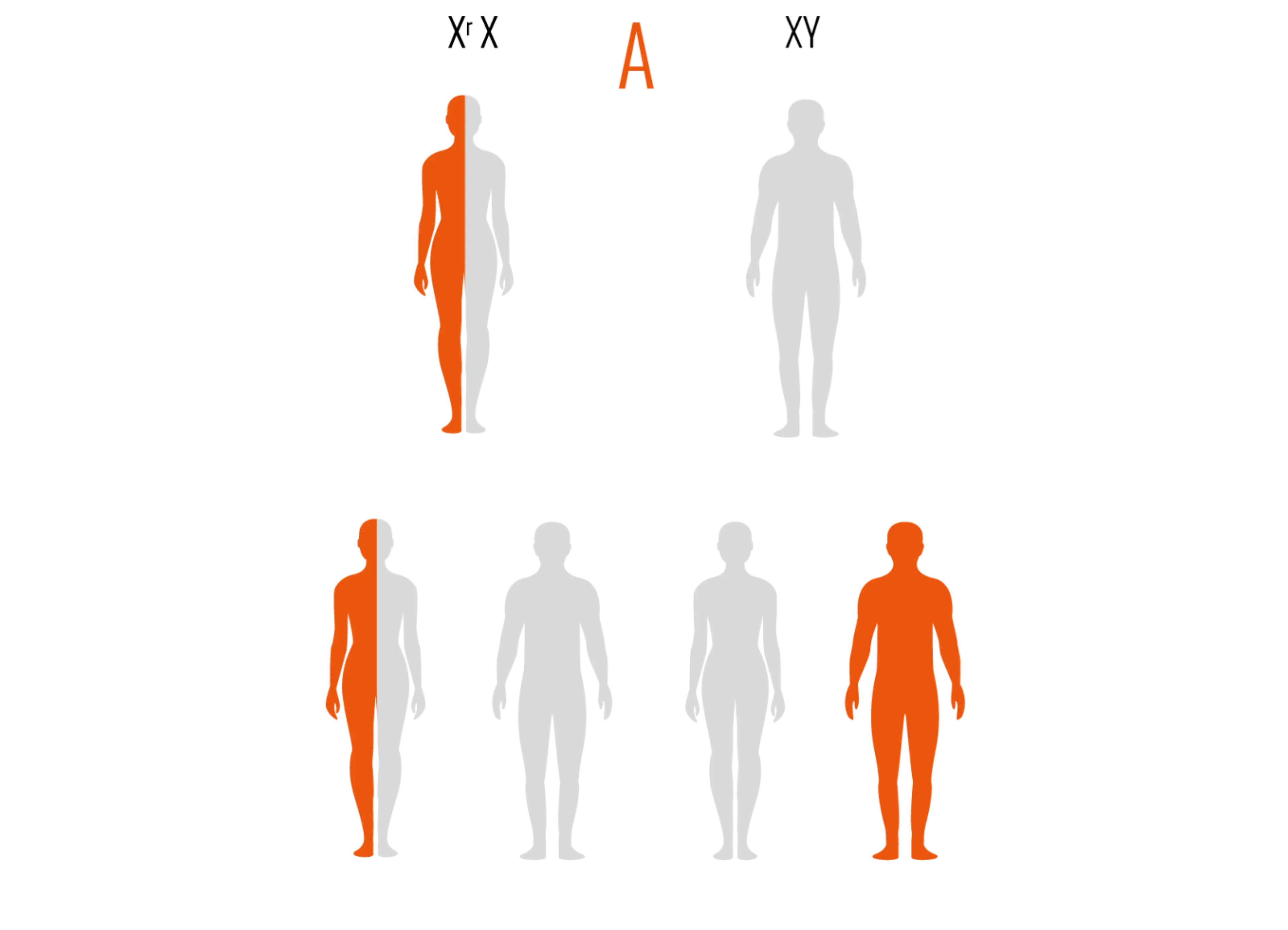.png)
Un homme atteint par la maladie transmettra son chromosome X muté à toutes ses filles et à aucun de ses garçons.
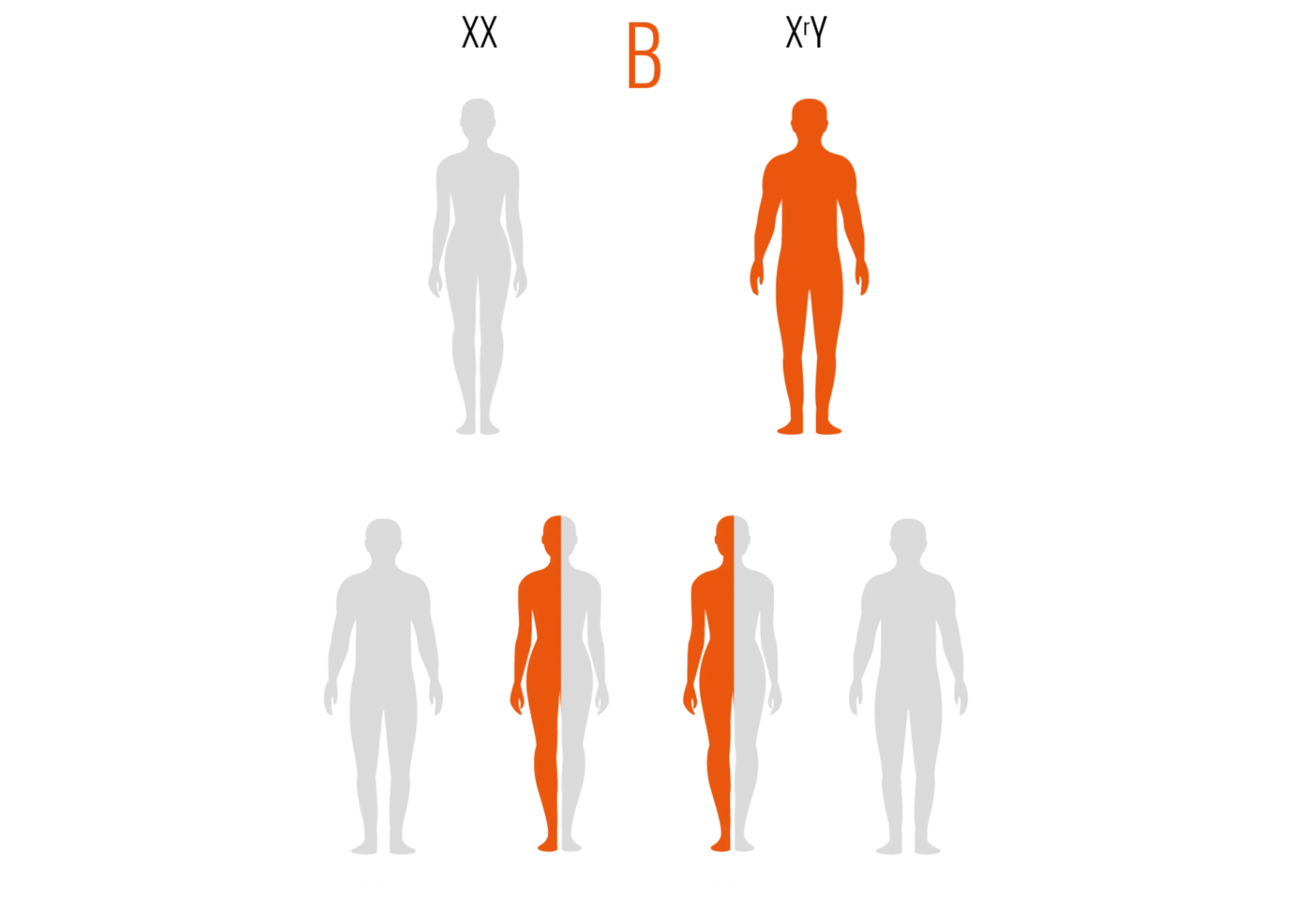.png)
La lyonisation du chromosome X, quelles conséquences sur le tableau clinique de la femme ?
La lyonisation du chromosome X pourrait jouer un rôle dans l’hétérogénéité du tableau clinique chez la femme atteinte d’une maladie de Fabry.2 L’inactivation ou lyonisation du chromosome X (XCI) est un processus par lequel l’un des 2 chromosomes X est aléatoirement inactivé au cours de l’embryogénèse dans chacune des cellules.
Ce mécanisme engendre une mosaïque de cellules saines (dû au variant non pathogène du gène GLA) et de cellules atteintes (dû au variant pathogène du gène GLA) dans des proportions variables.
L’expression d’un fort pourcentage du chromosome X porteur du variant pathogène engendrerait l’apparition d’une symptomatologie plus sévère chez la femme dans le tissu concerné.2
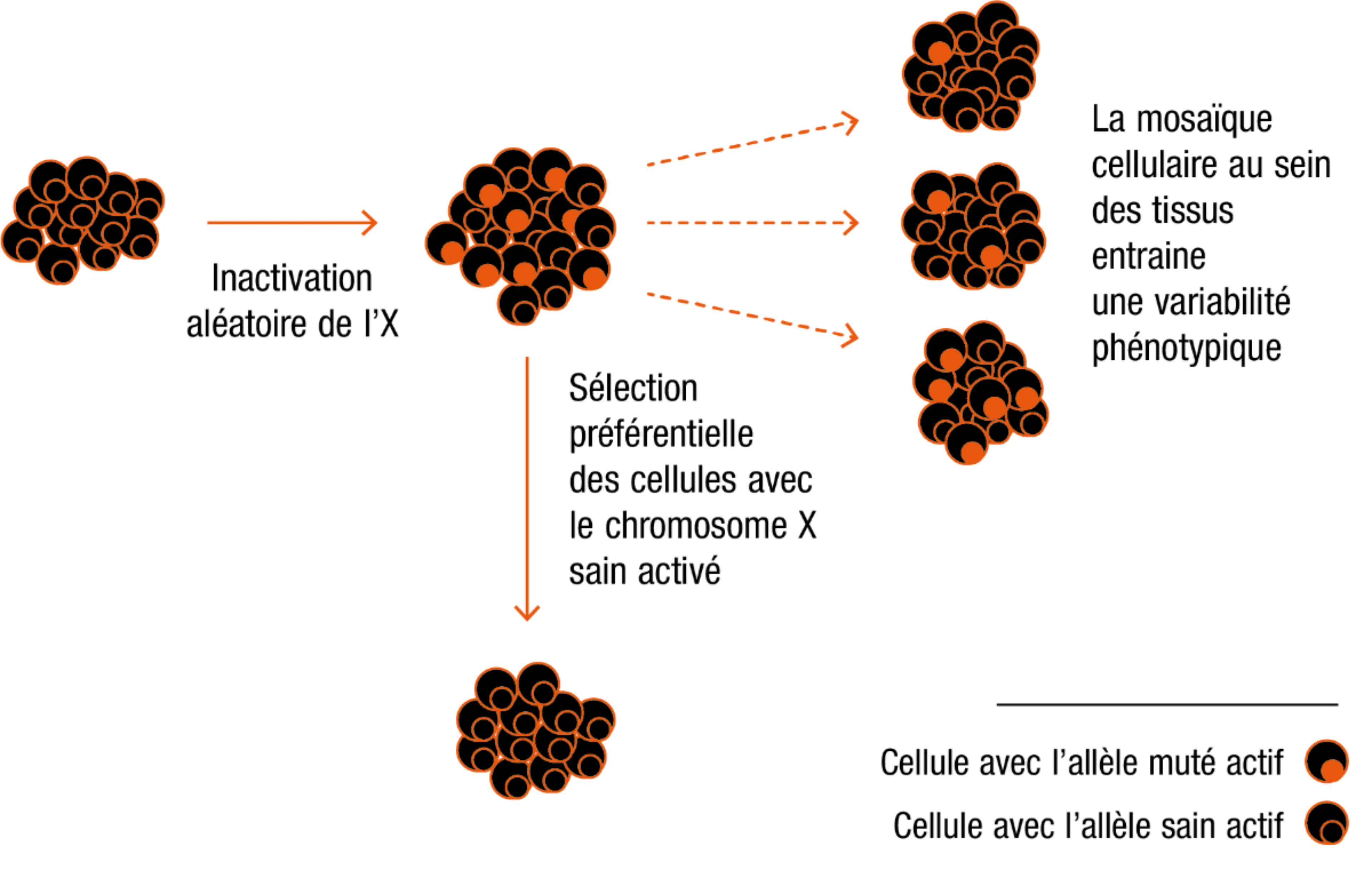
Représentation schématique de la lyonisation du chromosome X chez la femme (adapté de Taherian M et al. 20163)
Les femmes atteintes de la maladie de Fabry présentent donc un spectre clinique pouvant aller d’une maladie asymptomatique à une maladie dont la gravité et les atteintes sont similaires à celles d’un homme hémizygote.1
Quelles sont les manifestations cliniques de la maladie de Fabry chez les femmes ?
Les femmes atteintes de la maladie de Fabry ont une apparition plus tardive des symptômes par rapport aux hommes, mais potentiellement tout aussi sévères. La moyenne d’âge d’apparition des premiers symptômes est de 13 ans4 chez la femme (vs 9 ans4 chez l’homme).
De nombreuses femmes développent des atteintes impliquant les organes vitaux : les reins, le cœur et/ou le cerveau, environ une décennie plus tard par rapport aux hommes.2
Les atteintes cardiaques sont la 1ère cause de décès chez les femmes atteintes de la maladie de Fabry5. Sans prise en charge thérapeutique, 1 patiente sur 5 présente une Hypertrophie Ventriculaire Gauche (HVG) à 50 ans6. A l’inverse des hommes, les femmes peuvent développer une fibrose cardiaque avant apparition d’une HVG.7
Ainsi, même sans HVG, il est possible d’observer :
- une dysfonction diastolique entrainant de la dyspnée,
- de l’angor et une symptomatologie angineuse du fait d’une atteinte endothéliale,
- des arythmies, ainsi qu’une atteinte valvulaire.8
Observation de rehaussement tardif à la résonance magnétique cardiaque en fonction de l’épaisseur de la paroi ventriculaire gauche (septum interventriculaire) chez les femmes atteints de la maladie de Fabry.7
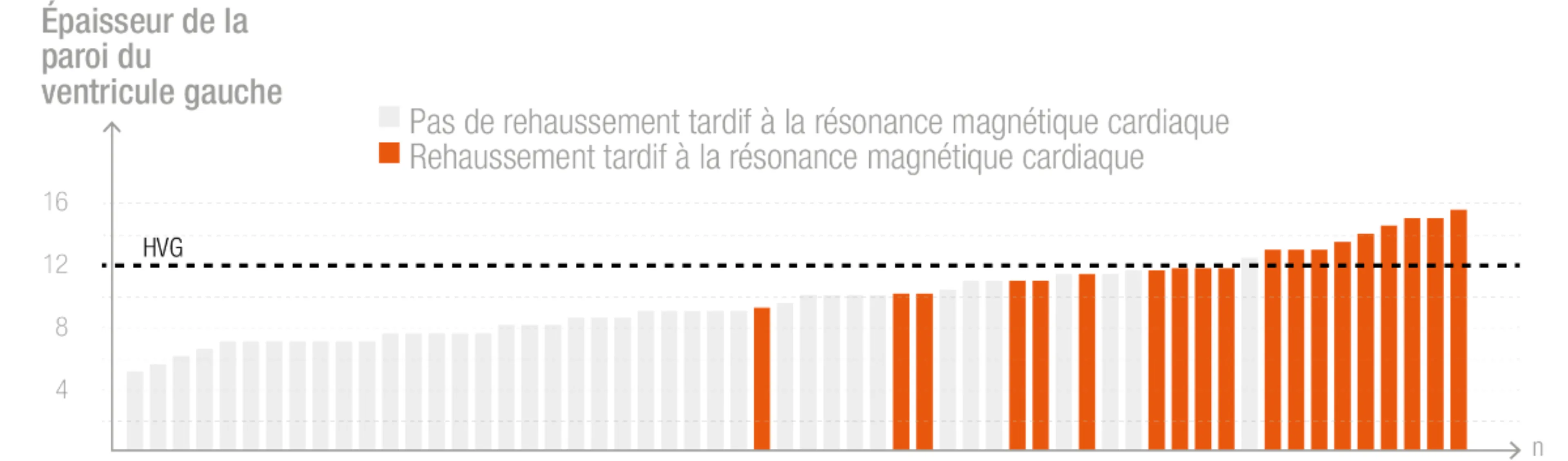
Sur la Figure 1, on observe que certaines patientes (indiquées en orange) présentaient déjà un rehaussement tardif sans manifestation d’une HVG.
Observation de rehaussement tardif à la résonance magnétique cardiaque en fonction de l’épaisseur de la paroi ventriculaire gauche (septum interventriculaire) chez les hommes atteints de la maladie de Fabry.7
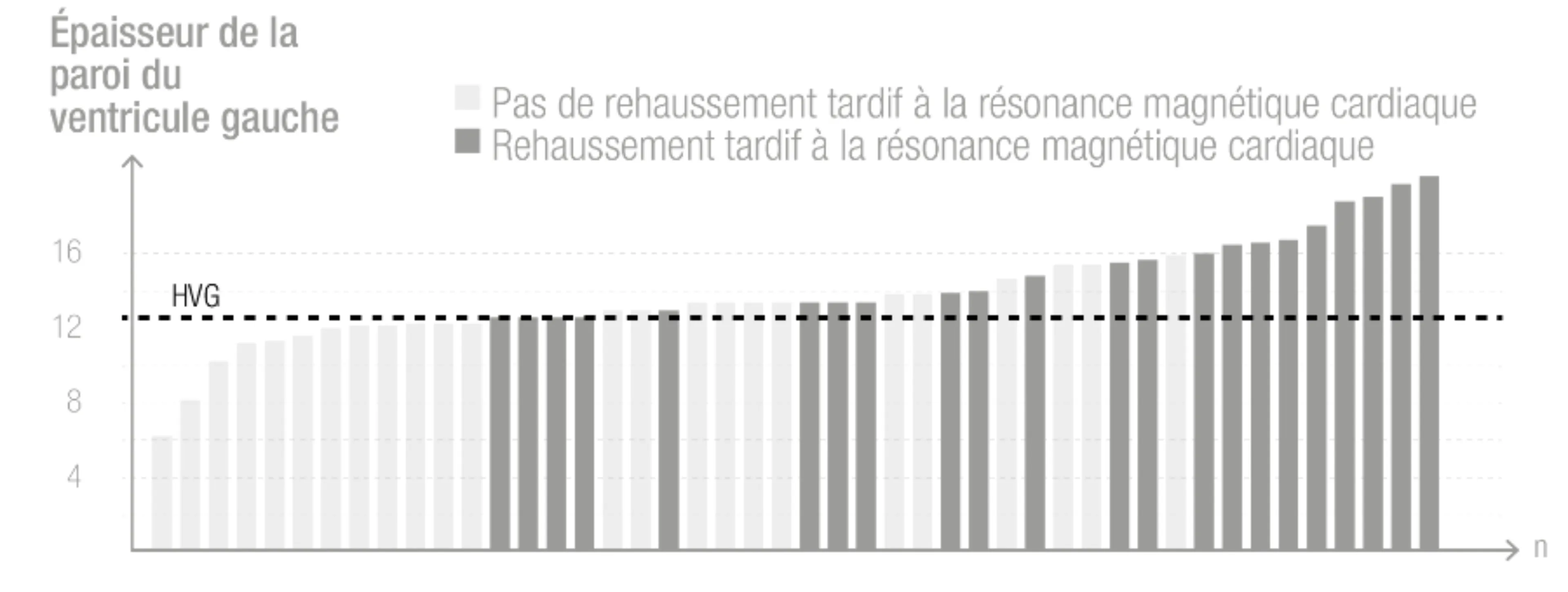
Sur la Figure 2, on observe que les patients présentant un rehaussement tardif (en gris foncé) ont également une épaisseur de la paroi du ventricule gauche ≥ 12 mm, annonciateur d’une HVG. Les patients de sexe masculin développent plus d’HVG que les patientes.
Dans le rein, le Gb3 s’accumule dans l’ensemble des cellules du glomérule, les capillaires péritubulaires, les cellules vasculaires endothéliales, musculaires lisses ainsi que tubulaires distales entrainant une perte progressive de la fonction rénale.9 L’atteinte rénale dans la maladie de Fabry concerne 35% des femmes.10
Chez les femmes ayant la maladie de Fabry, l’atteinte rénale peut se traduire par11 :
- Une protéinurie : supérieure ou égale à 300 mg/j chez 39% d’entre elles (vs 64% chez les hommes) voire à 3500 mg/j chez 7,5% d’entre elles (vs 9,0% chez les hommes)
- Une réduction du Débit de Filtration Glomérulaire (DFG) : inférieur à 60 ml/min/ 1,73 m² chez 19% d’entre elles (vs 33.6% chez les hommes).
- Une Insuffisance rénale chronique : de stade 3 chez 14,6% d’entre elles (vs 16,2% chez les hommes), voire de stade 4 ou 5 pour 4,4% d’entre elles.
Il est donc important de suivre la fonction rénale chez les femmes diagnostiquées d’une maladie de Fabry
L’Accident Vasculaire Cérébral (AVC) est une manifestation grave de la maladie de Fabry. L’âge médian au 1er AVC est de 45,7 ans chez les femmes (vs 39 ans chez les hommes). Il a été observé que plus d’un tiers des patientes (38,3%) ont présenté un épisode d’AVC avant d’avoir été diagnostiqués de la maladie de Fabry.
Tous les patients atteints de la maladie de Fabry doivent être surveillés afin de détecter d’éventuelles complications cérébrovasculaires, les AVC pouvant survenir en l’absence d’autres signes de la maladie.12
La maladie de Fabry touche aussi bien le Système Nerveux Central que le Système Nerveux Périphérique. Ainsi, tous les patients peuvent présenter des douleurs neuropathiques (acroparesthésies), une anhidrose ou hypohidrose, une intolérance à la chaleur, et des troubles auditifs (acouphènes, hypoacousies).1
Les atteintes cardiaques sont la 1ère cause de décès chez les femmes atteintes de la maladie de Fabry5. Sans prise en charge thérapeutique, 1 patiente sur 5 présente une Hypertrophie Ventriculaire Gauche (HVG) à 50 ans6. A l’inverse des hommes, les femmes peuvent développer une fibrose cardiaque avant apparition d’une HVG.7
Ainsi, même sans HVG, il est possible d’observer :
- une dysfonction diastolique entrainant de la dyspnée,
- de l’angor et une symptomatologie angineuse du fait d’une atteinte endothéliale,
- des arythmies, ainsi qu’une atteinte valvulaire.8
Observation de rehaussement tardif à la résonance magnétique cardiaque en fonction de l’épaisseur de la paroi ventriculaire gauche (septum interventriculaire) chez les femmes atteints de la maladie de Fabry.7

Sur la Figure 1, on observe que certaines patientes (indiquées en orange) présentaient déjà un rehaussement tardif sans manifestation d’une HVG.
Observation de rehaussement tardif à la résonance magnétique cardiaque en fonction de l’épaisseur de la paroi ventriculaire gauche (septum interventriculaire) chez les hommes atteints de la maladie de Fabry.7

Sur la Figure 2, on observe que les patients présentant un rehaussement tardif (en gris foncé) ont également une épaisseur de la paroi du ventricule gauche ≥ 12 mm, annonciateur d’une HVG. Les patients de sexe masculin développent plus d’HVG que les patientes.
Dans le rein, le Gb3 s’accumule dans l’ensemble des cellules du glomérule, les capillaires péritubulaires, les cellules vasculaires endothéliales, musculaires lisses ainsi que tubulaires distales entrainant une perte progressive de la fonction rénale.9 L’atteinte rénale dans la maladie de Fabry concerne 35% des femmes.10
Chez les femmes ayant la maladie de Fabry, l’atteinte rénale peut se traduire par11 :
- Une protéinurie : supérieure ou égale à 300 mg/j chez 39% d’entre elles (vs 64% chez les hommes) voire à 3500 mg/j chez 7,5% d’entre elles (vs 9,0% chez les hommes)
- Une réduction du Débit de Filtration Glomérulaire (DFG) : inférieur à 60 ml/min/ 1,73 m² chez 19% d’entre elles (vs 33.6% chez les hommes).
- Une Insuffisance rénale chronique : de stade 3 chez 14,6% d’entre elles (vs 16,2% chez les hommes), voire de stade 4 ou 5 pour 4,4% d’entre elles.
Il est donc important de suivre la fonction rénale chez les femmes diagnostiquées d’une maladie de Fabry
L’Accident Vasculaire Cérébral (AVC) est une manifestation grave de la maladie de Fabry. L’âge médian au 1er AVC est de 45,7 ans chez les femmes (vs 39 ans chez les hommes). Il a été observé que plus d’un tiers des patientes (38,3%) ont présenté un épisode d’AVC avant d’avoir été diagnostiqués de la maladie de Fabry.
Tous les patients atteints de la maladie de Fabry doivent être surveillés afin de détecter d’éventuelles complications cérébrovasculaires, les AVC pouvant survenir en l’absence d’autres signes de la maladie.12
La maladie de Fabry touche aussi bien le Système Nerveux Central que le Système Nerveux Périphérique. Ainsi, tous les patients peuvent présenter des douleurs neuropathiques (acroparesthésies), une anhidrose ou hypohidrose, une intolérance à la chaleur, et des troubles auditifs (acouphènes, hypoacousies).1
Ne faites pas une croix sur elles : comment diagnostiquer et prendre en charge la maladie de Fabry ?
Comment dépister la maladie de Fabry chez les femmes ?
Chez les femmes et les filles, l’activité de l’α-galactosidase A pouvant être normale, (du fait d’une inactivation préférentielle du chromosome X muté) le dosage du lyso-Gb3 plasmatique permet d’orienter le diagnostic.
Seul le génotypage du gène GLA permet de confirmer la présence d’un variant pathogène de la maladie de Fabry.1,13
Pour cela, il est important de recourir à un avis spécialisé en génétique pour interpréter la pathogénicité du variant.1
L’enquête familiale : une étape particulièrement importante
L’enquête familiale est particulièrement importante pour les patientes atteintes de la maladie de Fabry.14 Présentant un spectre plus hétérogène de symptômes que les hommes,2 et pouvant développer une fibrose cardiaque avant l’apparition d’une HVG7, l’enquête familiale permet ainsi d’identifier et de suivre ces patientes avant l’apparition de lésions irréversibles.14
Pour 1 cas index déterminé, on estime en moyenne qu’il y a 5 membres de famille diagnostiqués pour la maladie de Fabry 14
Quelle prise en charge thérapeutique pour les patientes atteintes de la maladie de Fabry ?
Il existe des traitements spécifiques permettant d’éviter la survenue de lésions irréversibles pour tous les patients atteints de la maladie de Fabry, d’où l’importance d’un diagnostic précoce et d’un suivi régulier.1
Références
1. PNDS Maladie de Fabry. HAS. Novembre 2021.
2. Germain DP. Orphanet Journal of Rare Diseases 2010; 5:30.
3. Taherian M. et al. International Clinical Neuroscience Journal 2016; 3(2): 81-91.
4. Eng, CM. et al. J Inherit Metab Dis (2007);30:184–192.
5. Hagège A. et al. Archives of Cardiovascular Disease. (2019) 112:278-87.
6. Wanner C. et al. ESC Heart Failure 2020;
7: 825-834. 7. Niemann M. et al. JACC Cardiovascular Imaging. 2011 Jun;4(6):592-601.
8. Linhart A. et al. EHJ (2007) 28, 1228-1235.
9. Wanner C. et al. Clin J Am Soc Nephrol 2010; 5:2220-2228.
10. MacDermot K.D, et al. J Med Genet. 2001; 38 : 769-775.
11. Wilcox W.R. et al. Molecular Genetics and Metabolism 93 (2008) 112–128
12. Sims et al. Stroke. 2009; 40:788-794.
13. Smid BE, et al. J Med Genet. 2015;0:1-7.
14. Laney DA, Fernhoff PM. J Genet Counsel. (2008) 17:79–83.
7000041773 - 03/23