- Article
- Source : Campus Sanofi
- 3 avr. 2023
Microbiote et pathologies mentales : où en est-on ?
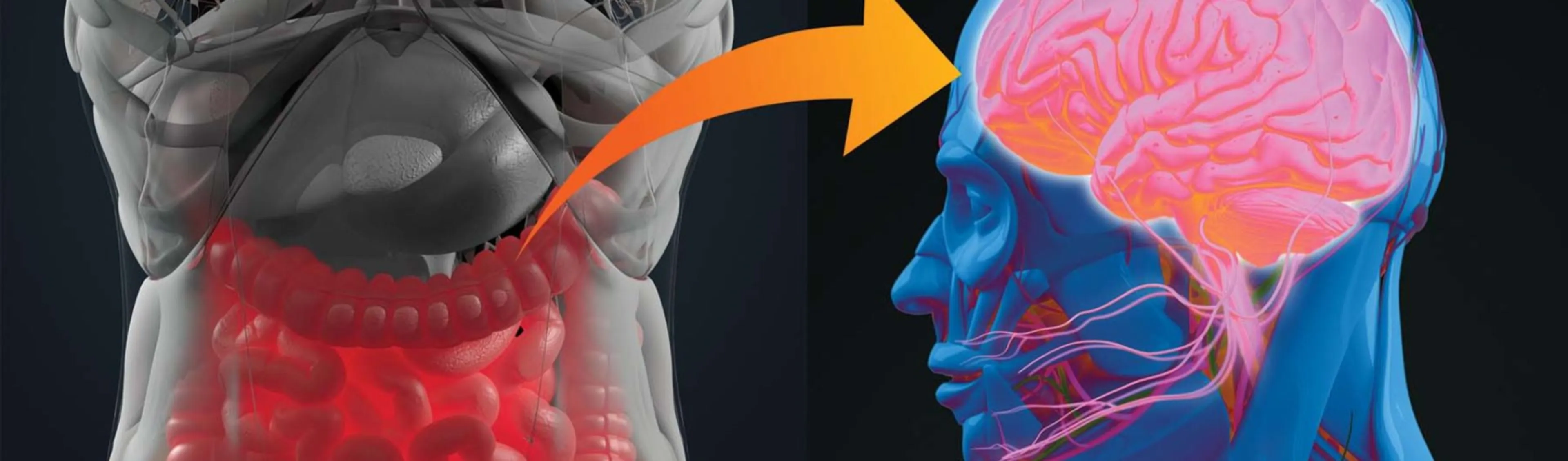
L’axe intestin-cerveau : des interactions surprenantes !
On définit l’axe « intestin-cerveau » par les interactions fonctionnelles qui existent entre le cerveau et le tube digestif, le système digestif exerçant des effets sur les fonctions cérébrales et vice-versa. Les premiers travaux menés sur cet axe se sont concentrés sur la digestion et la satiété, et actuellement la recherche se focalise sur les effets cognitifs.1
L'intestin et le cerveau peuvent être considérés comme des organes miroirs : le tube digestif contient en effet un vaste système nerveux intrinsèque appelé le système nerveux entérique (SNE, communément appelé le « 2e cerveau »), qui a d’ailleurs la même origine embryologique que le système nerveux central (SNC).2,3
Les interactions entre ces 2 organes s'exercent par de nombreuses voies, humorales et nerveuses, notamment via le système nerveux sympathique et parasympathique dont le nerf vague.1,2
Le nerf vague est le chemin le plus rapide et le plus court qui relie le cerveau et le système digestif. On retrouve au niveau des neurones entériques des fibres afférentes vagales, suggérant que ce nerf est un maillon dans la communication entre le cerveau et le système digestif. Il joue également un rôle sur la motilité gastro-intestinale et les fonctions de sécrétion, et il est impliqué dans le processus inflammatoire au niveau du cerveau, de l’intestin et d’autres organes.1,2
L’axe intestin-cerveau est particulièrement sensible aux facteurs présents au sein de la lumière du tube digestif, notamment le microbiote intestinal, au point où l’on parle même aujourd'hui d'axe « microbiote-intestin-cerveau ».2
Plusieurs médiateurs du dialogue entre microbiote et SNE ont été identifiés : acides gras à chaîne courte ou AGCC, acides biliaires secondaires, neuromédiateurs produits par certaines bactéries intestinales (GABA, dérivés du glutamate et du tryptophane dont les indoles…).2 Ces métabolites bactériens agissent sur le SNE via les cellules entéro-endocrines en modulant la production et la libération de sérotonine et de Glucagon-like peptide 1 (GLP-1). Il en résulte des modifications des fonctions digestives telles que la motricité intestinale et la vidange gastrique.2
Et au niveau du système nerveux central ? Le microbiote exerce des effets sur le SNC avant même la naissance. Le microbiote maternel influe en effet sur le développement cérébral du fœtus : chez des jeunes rats nés de mère axénique, la perméabilité de la barrière hémato-encéphalique est amoindrie et des anomalies de connexions entre différentes régions cérébrales ont été mises en évidence.2
Dans des études menées chez des jeunes souris axéniques, la colonisation par le microbiote de souris âgées induisait une diminution des capacités d'apprentissage et de mémorisation associée à une atteinte de la neurotransmission et de la structure des synapses.2
Chez l’homme, l'absence de microbiote peut induire des modifications du comportement, des déficits de mémoire ou encore des atteintes dans les interactions sociales. Le microbiote pourrait aussi influer sur la morphologie et la fonction des cellules immunitaires du système nerveux central : les microglies.2
Demain des psychobiotiques contre la dépression ?
On estime que 5 % des adultes souffrent de dépression dans le monde. Il s’agit de l’une des principales causes de handicap dans le monde. Ses effets peuvent être durables, récurrents, et peuvent affecter considérablement le quotidien.3
La prise en charge de la dépression par les approches pharmacologiques n’est pas toujours efficace et n’est pas exempte d’effets secondaires.2 Pour répondre à ces besoins non couverts, les scientifiques essaient de mieux comprendre la physiopathologie de la dépression, encore non élucidée. Dans ce contexte, un nouvel acteur semble émerger depuis une dizaine d’années : le microbiote.2,4,5
La composition du microbiote des patients atteints de dépression est différente de celui d’individus en bonne santé.4,5 Certaines études ont pu montrer qu’il pouvait notamment être caractérisé par une présence moindre de Bifidobacterium et de Lactobacillus associée à une augmentation des Bacteroides et des protéobactéries.2,5
Cette dysbiose serait alors responsable de perturbations au niveau du système sérotoninergique intestinal par l’intermédiaire de différents médiateurs (indoles, métabolites bactériens, tryptophane)2 et pourrait expliquer en partie les symptômes dépressifs.4 Cependant, d’autres études ont mis en évidence des compositions différentes du microbiote chez les patients dépressifs, et il n’existe pas encore de consensus sur la caractérisation de la dysbiose dans cette population.1,5
Lire aussi : Microbiote intestinal : dysbiose et perspectives thérapeutiques, une interview du Pr Harry Sokol, Gastroentérologue et co-directeur de l'équipe « Microbiote, Intestin et inflammation » (INSERM CRSA)
Un autre élément d’explication qui participe à l’émergence du microbiote dans la physiopathologie de la dépression repose sur la transplantation fécale. Si l'on transfère le microbiote fécal de patients dépressifs chez un animal, celui-ci adoptera des comportements de type anxieux et dépressif, accompagnés d'altération du métabolisme du tryptophane au niveau cérébral.2
Écouter aussi : Microbiote et transplantation fécale : applications actuelles et perspectives, le podcast interview du Pr Harry Sokol, Gastroentérologue et co-directeur de l'équipe « Microbiote, Intestin et inflammation » (INSERM CRSA)
Le tryptophane est un acide aminé essentiel qui est métabolisé au niveau digestif par le microbiote et les cellules de l'intestin. La dysbiose modifie le métabolisme du tryptophane en favorisant sa dégradation en dérivés neuro-inflammatoires qui pourraient contribuer à la survenue de la dépression et à la résistance au traitement pharmacologique.2
Cependant, les conséquences précises des altérations du microbiote sur la dépression ne sont pas encore élucidées et d’autres travaux sont nécessaires avant de pouvoir envisager des pistes thérapeutiques chez l’homme.1,5
Des résultats prometteurs sur l’effet des psychobiotiques sur les scores de dépression ont été obtenus dans des études précliniques et chez des patients en bonne santé, mais nécessitent la confirmation d’études cliniques.5
Microbiote et anxiété : les études cliniques manquent encore
La plupart des études étudiant les liens entre la dépression et l'axe microbiote-intestin-cerveau s'intéressent également à l'anxiété. Les preuves viennent majoritairement d'études précliniques qui indiquent que des rongeurs axéniques peuvent présenter des comportements exagérés de réactions au stress, et que l'apport d’un traitement probiotique chez ces rongeurs pourrait moduler le niveau d’anxiété. De rares études ont pu montrer des améliorations de l'anxiété après administration de probiotiques spécifiques, mais d'autres études sont nécessaires pour confirmer les effets d'éventuels psychobiotiques sur l'anxiété.1
Addiction à l’alcool : l’inflammation en première ligne
Les addictions sont caractérisées par un déséquilibre des neurotransmetteurs au niveau du circuit de récompense cérébral : dopamine, opioïdes, sérotonine, GABA, glutamate... Parmi les addictions, la dépendance à l’alcool est particulièrement fréquente : elle concerne 4 % de la population mondiale et est responsable de 2,2 % des décès féminins et 6,8 % des décès masculins.6
L’impact de l’abus d’alcool sur le microbiote a été particulièrement étudié.1 La composition du microbiote des patients alcoolodépendants peut être altérée, avec une diminution des Bacteroidetes et des Ruminococcaceae (dont Faecalibacterium prausnitzii, aux propriétés anti-inflammatoires). Et la sévérité de cette dysbiose semble être associée à la sévérité de l'anxiété, de la dépression et de l'appétence à l'alcool.2
Deux mécanismes peuvent aider à comprendre l’effet de l’alcool sur le microbiote.2
Le premier concerne l'inflammation périphérique. En effet, l’alcool altère la barrière intestinale, ce qui favorise la translocation d'endotoxines bactériennes de la lumière du tube digestif vers la circulation sanguine.5 Ces endotoxines sont des puissants agents pro-inflammatoires qui vont venir activer les leucocytes entraînant la libération dans le sang de cytokines pro-inflammatoires.
Les taux de ces cytokines sont d’ailleurs corrélés à la sévérité de la dépression, de l'anxiété et de l'appétence à l'alcool. L’inflammation qui en résulte pourrait également avoir des répercussions sur les zones cérébrales impliquées dans les performances cognitives, le comportement social, le stress et le contrôle des émotions.2
Le 2e mécanisme implique la production par les bactéries intestinales de métabolites neuroactifs et de neurotransmetteurs qui pourraient influencer la neurotransmission dopaminergique impliquée dans le phénomène de récompense aux drogues.2
Ces données laissent à penser que la modulation du microbiote intestinal pourrait s'avérer bénéfique dans le traitement et la prise en charge des patients alcooliques.6 Il a été montré par exemple que la transplantation de microbiote de patients alcooliques à des souris reproduisait chez celles-ci un comportement dépressif et une baisse des interactions sociales associées à une neuro inflammation, une perturbation des neurotransmetteurs GABA et glutamate et une réduction de l'expression des gènes liés à la synthèse de la myéline.
Une récente étude clinique de transplantation fécale réalisé chez des patients alcoolodépendants a montré une amélioration significative des scores de dépendance à l'alcool, une amélioration des fonctions cognitives et des paramètres psychosociaux. Les taux circulants de certaines cytokines pro-inflammatoires ont été également diminués.2
Toutefois les mécanismes d'action de la transplantation fécale chez l'homme ne sont pas encore décrits2 et d’autres études doivent être menées pour préciser le rôle du microbiote dans l’addiction à l’alcool et les éventuelles pistes thérapeutiques dont il pourrait être la cible.6
Les données actuelles laissent à penser que les effets des autres substances addictives sont similaires à ceux de l’alcool. Il a par exemple été montré un lien entre tabagisme, dysbiose et inflammation.1
Trouble du spectre de l’autisme : une dysbiose spécifique
On parle de « trouble du spectre de l’autisme » (TSA) pour appréhender la réalité très large, très variée et très hétérogène de l’autisme. Les critères diagnostiques actualisés par le DSM-5 sont définis dans deux dimensions symptomatiques qui sont :
- les déficits persistants de la communication et des interactions sociales observés dans des contextes variés ;
- le caractère restreint et répétitif des comportements, des intérêts ou des activités.7,8
Il est estimé qu’environ 100 000 jeunes de moins de 20 ans et près de 600 000 adultes sont autistes en France.7
Le TSA est lié à des anomalies très précoces du neurodéveloppement avec des défauts de mise en place et d’organisation de certains réseaux cérébraux dédiés à la communication sociale et à la modulation du comportement en fonction de l’environnement et de ses changements. Il est désormais bien établi qu’il s’agit d’une maladie d’origine multifactorielle, avec une forte composante génétique.9
Environ 70 % des enfants autistes présentent des symptômes gastro-intestinaux (douleurs abdominales, diarrhée, constipation), indiquant une atteinte de la physiologie intestinale. Une dysbiose spécifique chez les enfants autistes a pu être mise en évidence, avec une abondance de Bifidobacterium, de Prevotella et de Faecalibacterium prausnitzii ainsi qu'une augmentation de l'abondance de bactéries potentiellement pathogènes telles que Desulfovibrio et Clostridia.2
Les études menées sur des modèles animaux ont montré que le microbiote jouait un rôle essentiel dans le développement des relations sociales : en rétablissant l’équilibre du microbiote chez des souris axéniques, il est possible de corriger les défauts de perméabilité de la barrière intestinale, mais aussi d’agir sur les symptômes du TSA en réduisant la production et l’absorption de toxines dans l’intestin.10
Même s'il a été montré un effet bénéfique de la supplémentation en certaines bactéries sur le comportement social dans différents modèles animaux, il n'existe à l'heure actuelle que très peu de preuves cliniques chez l'homme.2 Une récente revue systématique de la littérature a indiqué qu’on ne pouvait pas encore établir de conclusions sur les effets bénéfiques de l’apport de probiotiques sur les TSA.10
Les études cliniques manquent encore
Dépression, anxiété, addiction, TSA... Ces quelques exemples montrent l’attrait de la recherche pour mieux comprendre l’impact du microbiote sur notre santé mentale. Cependant, de nombreuses études cliniques sont encore nécessaires avant d’envisager l’arrivée sur le marché de psychobiotiques...
Références
- Cryan JF et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019;99(4):1877-2013.
- Jean-Michel Lecerf, Nathalie Delzenne. Microbiote intestinal et santé humaine. Elsevier Masson, 2021
- OMS. Site internet. https://www.who.int/fr/health-topics/depression#tab=tab_1 Site consulté le 15 mars 2023.
- Chang L et al. Brain–gut–microbiota axis in depression: A historical overview and future directions. Brain Research Bulletin. 2022;182:44-56.
- Barandouzi Za et al. Altered Composition of Gut Microbiota in Depression: A Systematic Review. Front Psychiatry. 2020;11:541.
- Wang SC et al. Alcohol Addiction, Gut Microbiota, and Alcoholism Treatment: A Review. Int J Mol Sci. 2020;21(17):6413.
- Ministère des Solidarités, de l’autonomie et des personnes hanidcapées. Site internet. https://handicap.gouv.fr/la-strategie-nationale-autisme-et-troubles-du-neuro-developpement site consulté le 15 mars 2023.
- HAS. Recommandations de bonne pratique. Trouble du spectre de l’autisme. Signes d’alerte, repérage, diagnostic et évaluation chez l’enfants et l’adolescent. Février 2018.
- INSERM. Site internet. https://www.inserm.fr/dossier/autisme/ Site consulté le 15 mars 2023.
- Prosperi M et al. Interventions on Microbiota: Where Do We Stand on a Gut-Brain Link in Autism? A Systematic Review. Nutrients. 2022 ;14(3):462.
MAT-FR-2204790 - 04/2023